
東邦大学理学部生物学科
幹細胞リプログラミング研究室
多田�政子, PhD
リプログラミング | Masako Tada|東邦大学理学部生物学科

MASAKO TADA
Stem Cells & Reprogramming Laboratory
我々の研究室では、ヒトおよびマウスを中心とした哺乳類細胞核でのゲノム全体のエピジェネテクスの書換え機構について研究しています。
同一個体の全ての組織細胞は同じDNA配列を持ちますが、それぞれの細胞種特有の遺伝子発現パターンをもたらしているのがエピジェネテクスです。その主なものとしてDNAシトシンのメチル化、クロマチン構造を司るヒストンタンパク質の修飾などがあります。
エピジェネテクスは発生過程でドラマチックな変化を遂げますが、その可逆性から、もとの状態に戻すことも可能です。この過程は、リプログラミングと呼ばれ、核の多能性の再獲得と次世代への安定な遺伝情報の伝搬に重要であると考えられます。
リプロプロセスのプロセスを以下3つに細分化して迫ろうとしています:
(1) DNAシトシンのメチル化制御機構
(2) リプログラミング開始機構
(3) クロマチンタンパク質の更新(恒常性維持)機構
リプログラミング
哺乳類における生命現象をin vitroモデル細胞を用いて解析する
創薬開発における非臨床試験を支援するヒトモデル細胞の作製
モデル細胞として以下の幹細胞や胚細胞を用いています。
(1) マウス胚性幹細胞;embryonic stem cells (ESCs)
(2) ヒト人工多能性幹細胞;induced pluripotential stem cells (iPSCs)
(3) マウスエピ幹細胞:epiblastic stem cells (EpiSCs)
(4) ニワトリ胚の線維芽細胞:chicken embryonic fibroblasts (CEFs)
モデル細胞として以下の幹細胞や胚細胞を作製しています。
(1) 光るヒトiPS細胞株
(2) 光るヒト肝がん細胞株HepaRG
(3)光るヒト肝がん細胞株HepG2
リプログラミング研究の意義
リプログラミング現象は、核移植クローンに始まって、我々が実施したES細胞と体細胞の細胞融合、4因子(Oct4, Sox2, Klf4, cMyc)によるiPS細胞誘導によって認知されるようになりました。しかし、リプログラミングは特殊な技術を用いて「誘導」しなくても、本来、正常胚発生においてライフサイクルを担う生殖系列で常に起きている現象です。特に、受精後から着床までの間と未熟な生殖細胞(primordial germ cells, PGCs)の発生過程で起きます。この両者には、異なる特性があるため、前者を胚性リプログラミング、後者を生殖性リプログラミングと呼ぶことにします。我々は、この一連のリプログラミングの機構を明らかにしようとしています。
胚性リプログラミングは、核が多能性を獲得して発生を進め、個体や胎盤などの胚体外組織を形成するために必須です。一方、生殖性リプログラミングでは、ゲノム全体のエピジェネテクスを最小限にして1世代の記憶をリセットする働きがあります。哺乳類の細胞には、精子由来と卵子由来の染色体のセットが含まれていますが、この両者間の特定の領域にはゲノムインプリンティングとよばれるエピジェネティックな違いがあります。このゲノムインプリンティングはPGCsでのみ消去され、相同染色体間の差が最小限になります。このPGC核の状態を、デフォルト(初期化または基底状態)といい、最も核が若返った状態になります。よって、少々飛躍しますが、リプログラミングの仕組みを明らかにすることの意義は、種の連続性を理解することにつながるのです。
胚性リプログラミング
我々は、幹細胞との体細胞の細胞融合法を用いて、マウスESCsでは、胚性リプログラミング活性が失われることなく常に働いていることを明らかにしました。この働きにより、細胞融合によって体細胞核をES細胞に導入すると、体細胞核がESC核と同様の性質(エピジェネティクス)になるようにリプログラミングされることが分かりました。そこで、我々は、ESCsが持つ胚性リプログラミング活性とは、どのような性質と役割をもつのか解析してきました。これまでのところ、ESC核自体のエピジェネティクスは常に一定のパターンに回復するよう動的に制御されていることが分かって来ました。このように、新たなエピジェネティクスが付けられたり消されたりと不安定な状態になっている領域がある一方で、不活性状態が安定に維持されている領域が存在します。図の赤く光る染色体領域は、5-ヒドロキシメチルシトシンを多く含み、DNAのメチル化消去とDNAのメチル化を細胞周期依存的に繰り返している領域で、ユークロマチンと呼ばれる緩いクロマチン構造を持っています(Kubiura, M.et al., Chromosome Research, 20 (7): 837-48, 2012)。
生殖性リプログラミング
我々は幹細胞との体細胞の細胞融合法を用いて、マウスPGCs由来の生殖性幹細胞EGCsには、生殖性のリプログラミング活性があることを見出しました。この働きにより、細胞融合によって体細胞核を導入するとその核のゲノムインプリンティングを消去できることが分かりました。
近年、ESCsからPGC様の細胞(PGC-LCs)をつくりだすことができるようになりました、そこで、我々は、ESCsを用いてPGC-LCsになる過程で起きる生殖性リプログラミング機構を詳細に解析しています。
マウスESCs(左)とヒトiPSCs(右)ヒトiPSCsはマウスより発生の進んだ段階にある。


ニワトリをモデル動物とした胚発生過程でのリプログラミング研究

抗体を用いたエピジェネティクス解析。マウスESCsの中期染色体と間期核の5-ヒドロキシメチルシトシン(赤)のユークロマチン局在。ヘテロクロマチン領域は、DAPIで青く強染される。矢印:Y染色体。
ニワトリ初期胚でのリプログラミング研究
ニワトリ受精卵を使うと、初期胚でのエピジェネティクな変化をマウスより容易かつ安価に解析できる利点があります。また、鳥類は、四足類として硬骨魚類から進化して陸上にあがり、もう絶滅した恐竜の生き残りとして位置づけられています。また、ニワトリと哺乳類は同じ有羊膜類に含まれます。よって、ニワトリとマウスにおけるエピジェネティクスの比較研究は、現存の硬骨魚類、爬虫類、有袋類、哺乳類などに一般化できた場合、その制御機構の進化的意義を理解するのに役立つと期待されます。ニワトリやウズラ系統の受精卵は名古屋大学大学院生命農学研究科付属の”鳥類バイオサイエンス研究センター"から提供頂いています。
この研究では、核内のDNAメチル化領域を可視化する目的で、DNAのメチル化領域に特異的に結合する蛋白質MBD1のDNA結合領域にGFPが融合した蛋白質を発現するベクターをRIKENの阿部訓也先生から分与頂いてニワトリ細胞に導入しています。図は、このMBD-GFPを発現するマウスESCsのライブセルイメージングで、緑に光る領域にDNAメチル化が集積しています。
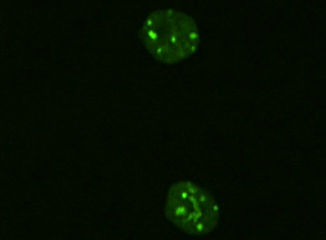
MBD-GFP発現ベクターを用いたDNAメチル化領域の可視化


CYP3A7を発現している胎児性肝細胞(肝芽細胞)は赤く光り、CYP3A4を発現している機能的に成熟した成人型肝細胞は緑に光る。
このレポーター遺伝子をCYP3A4G/7Rと呼ぶ。これを導入したヒト肝癌細胞株HepaRGは、肝細胞に分化すると赤から緑に色調が変化する(Tsuji, S. et al., 2014)。
創薬開発支援:ヒト組織細胞の代替細胞提供
ESCsやiPSCsは、我々の体を構成している様々な組織細胞(神経、心筋、肝細胞、膵臓など)に分化する能力をもちます。また、無限に増えることから、再生医療に必要な組織細胞の供給源として期待されています。また、創薬開発において、薬効薬理・安全性試験に利用できるヒト肝細胞の安定供給が期待されています。現在は、手術等により切除した肝臓から肝細胞を取り出した初代培養細胞が使われています。この作業は日本で認可されていないため輸入に頼っています。また、解凍肝細胞は質的に不均質で増殖能がほとんどないという欠点があり、安定した化合物の評価が困難な理由になっています。よって、生体肝細胞の代わりになるヒト肝細胞がヒトiPS細胞から作り出すことが期待されています。しかし、ヒトiPS細胞から”機能的”な肝細胞をつくりだすのは非常に難しいのが現状です。
我々は、肝細胞分化誘導系の確立には、そのプロセスをリアルタイムに迅速かつ安価に定量評価できる光るレポーターの作製が不可欠と考えました。この光るレポーターを導入した幹細胞は、胎児の肝細胞である肝芽細胞(hepatoblasts)になると赤く光り、成人肝細胞になると緑に色調が変化して光ります。現在、マウスESCsから大量の赤く光る肝芽細胞をつくれるようになってきました。ヒトiPSCsはマウスESCsと異なる特性を持ちます。そのため、肝細胞分化方法も異なります。ヒトiPS細胞は、マウスではES細胞とエピ幹細胞の間ぐらいの分化段階にあり、エピブラスト分化を開始している細胞として扱うことが必要です。